प्रत्येक अभिक्रिया के लिए ऊर्जा अवरोध होता है नए उत्पादों का निर्माण केवल उस स्थिति में ही हो सकता है जब अभिकारक के पास इस ऊर्जा अवरोध को पार करने के लिए पर्याप्त ऊर्जा उपस्थित हो। आइये सक्रियण ऊर्जा पर अध्ययन करते हैं।
सक्रियण ऊर्जा
किसी रासायनिक अभिक्रिया में अभिकारक के अणु परस्पर टकराते रहते हैं इन टक्करों के द्वारा उत्पाद बनते हैं। अभिकारकों के वे अणु ही उत्पाद बनते हैं जिनके पास पर्याप्त ऊर्जा होती है। इन अणुओं को सक्रिय अणु कहते हैं।
अभिकारक अणुओं के संघट्ट से प्राप्त वह ऊर्जा की अतिरिक्त मात्रा जो अभिक्रिया कराने के लिए पर्याप्त होती है। एवं इसके फलस्वरूप उत्पाद बनते हैं। सक्रियण ऊर्जा (activation energy in Hindi) कहलाती है। इसे Ea द्वारा व्यक्त किया जाता है।
सक्रियण ऊर्जा = देहली ऊर्जा – अभिकारक अणुओं की ऊर्जा
प्रत्येक अभिक्रिया के लिए सक्रियण ऊर्जा का मान निश्चित होता है। ताप बढ़ने पर सक्रिय अणुओं की संख्या को बढ़ाया जा सकता है जिससे अणुओं के मध्य टक्करों के फलस्वरूप अभिक्रिया का वेग बढ़ जाता है।
सक्रियण ऊर्जा तथा वेग स्थिरांक में संबंध
इस संबंध को आर्हीनियस समीकरण द्वारा स्थापित किया जा सकता है।
आर्हीनियस समीकरण से k = Ae-Ea/RT
जहां k = अभिक्रिया का वेग स्थिरांक, R = गैस नियतांक, T = परमताप, A = आवृत्ति गुणांक तथा Ea = सक्रियण ऊर्जा है।
k = Ae-Ea/RT
दोनों और लघुगणक लेने पर

इस समीकरण द्वारा स्पष्ट होता है कि ताप का मान बढ़ाने पर k अर्थात् अभिक्रिया के वेग का मान बढ़ता है।
सक्रियण ऊर्जा की गणना
यदि किसी अभिक्रिया के लिए T1 परमताप पर वेग स्थिरांक k1 तथा T2 परम ताप पर वेग स्थिरांक k2 हो तो
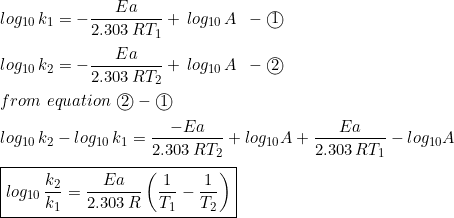
उपरोक्त समीकरण द्वारा दो विभिन्न तापक्रमों पर अभिक्रिया के वेग स्थिरांक के मापित मान की सहायता से सक्रियण ऊर्जा (Ea) की गणना की जा सकती है।
सक्रियण ऊर्जा के उदाहरण
- 600K तथा 700K तापक्रमों पर अभिक्रिया के वेग स्थिरांक के मान क्रमशः 1.6 × 10-5 तथा 6.36 × 10-3 प्रति सेकंड है। तो अभिक्रिया के लिए सक्रियण ऊर्जा की गणना कीजिए?
हल :- T1 = 600K , T2 = 700K
k1 = 1.6 × 10-5 , k2 = 6.36 × 10-3
R = 8.314 J/mol-K
उपरोक्त सूत्र की सहायता से

