वाष्प दाब का आपेक्षिक अवनमन
जब कोई अवाष्पशील पदार्थ किसी विलायक में घोला जाता है तो विलायक के वाष्प दाब में कमी आ जाती है। वाष्प दाब में आयी इस कमी को वाष्प दाब का अवनमन कहते हैं।
यदि किसी शुद्ध विलायक का वाष्प दाब P° तथा विलयन का वाष्प दाब Ps हो तो
वाष्प दाब का अवनमन = P° – Ps
किसी विलयन के वाष्प दाब का अवनमन (P° – P) तथा विलायक के वाष्प दाब (P°) के अनुपात को वाष्प दाब का आपेक्षिक अवनमन (relative lowering of vapour pressure in Hindi) कहते हैं।

वाष्प दाब का अवनमन तथा वाष्प दाब का आपेक्षिक अवनमन दोनों अणुसंख्यक गुणधर्म है। यह गुणधर्म विलेय कणों की संख्या पर निर्भर करते हैं। विलेय की प्रकृति पर निर्भर नहीं करते हैं।
वाष्प दाब का आपेक्षिक अवनमन का सूत्र
राउल्ट के नियम के अनुसार, वाष्प दाब का आपेक्षिक अवनमन विलयन में विलेय के मोल प्रभाज के बराबर होता है। तो

जहां n तथा N विलयन में उपस्थित विलेय तथा विलायक के मोलों की संख्या है।
तनु विलयन के लिए n << N अतः हर में n को छोड़ने पर

जहां w तथा W विलेय तथा विलायक की मात्रा (भार) एवं m तथा M विलेय तथा विलायक के मोलर द्रव्यमान (अणुभार) हैं।
वाष्प दाब का आपेक्षिक अवनमन के उदाहरण
- 298K ताप पर जल का वाष्प दाब 23.75 mm Hg है इस ताप पर यूरिया (NH2CONH2) के 5% जलीय विलयन का वाष्प दाब ज्ञात कीजिए?
हल :- ∵ यूरिया का विलयन का सांद्रण 5% है तो
विलेय यूरिया का भार (w) = 5g
विलायक जल का भार (W) = 100-5 = 95g
जल का वाष्प दाब (P°) = 23.75 mm
जल का अणुभार (M) = 2×1 + 16 = 18
यूरिया (NH2CONH2) का अणुभार (m) = 60
विलयन का वाष्प दाब Ps = ?
वाष्प दाब के सूत्र से
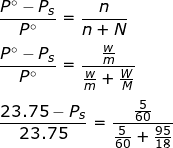
23.75 – Ps = 23.75 × 0.016
Ps = 23.75 – 0.38
Ps = 23.37 mm Hg
अतः 298K ताप पर विलयन का वाष्प दाब 23.37 mm Hg है।
- किसी पदार्थ के 18.1 ग्राम को 100 ग्राम जल (H2O) में मिलाया जाता है। विलयन का वाष्प दाब 87 mm है। इसी ताप पर जल का वाष्प दाब 92 mm हो तो पदार्थ के अणुभार की गणना कीजिए?
हल :- विलेय यूरिया का भार (w) = 18.1 g
विलायक जल का भार (W) = 100 g
जल का वाष्प दाब (P°) = 92 mm
विलयन का वाष्प दाब Ps = 87 mm
जल का अणुभार (M) = 2×1 + 16 = 18
विलेय पदार्थ का अणुभार (m) = ?
वाष्प दाब के सूत्र से

अतः विलेय पदार्थ का अणुभार 59.95 है।

