फ्रेंच रसायनज्ञ फ्रेंसियस मार्टे राउल्ट ने वाष्प दाब अवनमन के बीच एक मात्रात्मक संबंध दिया। जिसे राउल्ट का वाष्प दाब अवनमन नियम (Raoult’s law in Hindi) कहते हैं।
राउल्ट का नियम
इस नियम के अनुसार, वाष्पशील द्रवों के एक विलयन में प्रत्येक घटक का आंशिक वाष्प दाब विलयन में उस घटक के मोल प्रभाज के समानुपाती होता है।
माना विलयन में दो वाष्पशील अवयव A तथा B हैं विलयन में इनके आंशिक दाब क्रमशः PA तथा PB हैं और उनके मोल प्रभाज क्रमशः XA तथा XB हैं तो
राउल्ट के नियमानुसार
PA ∝ XA
PA = P°A XA —①
जहां P°A शुद्ध घटक A का समान ताप पर वाष्प दाब है इसी प्रकार
PB ∝ XB
PB = P°B XB —②
जहां P°B शुद्ध घटक B का समान ताप पर वाष्प दाब है
विलयन का वाष्प दाब P = PA + PB
तब समीकरण ① व ② से
P = P°A XA + P°B XB —③
∵ हम जानते हैं कि विलयन के घटकों के मोल प्रभाज का योग 1 होता है तो
XA + XB = 1
XA = 1 – XB
XA का मान समीकरण ③ में रखने पर
P = P°A(1 – XB) + P°B XB
P = P°A – P°AXB + P°B XB
P = P°A + XB(P°B – P°A)
एक निश्चित ताप पर P°A तथा P°B का मान निश्चित होता है। अतः विलयन का कुल वाष्प दाब घटक के मोल प्रभाज का रेखीय फलन है।
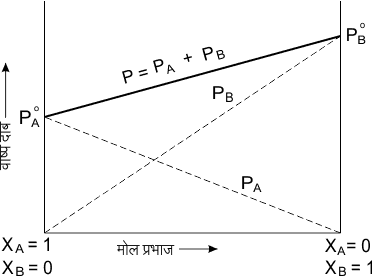
अवाष्पशील विलेय युक्त विलयन के लिए राउल्ट का नियम
किसी निश्चित ताप पर एक अवाष्पशील विलेय युक्त विलयन का वाष्प दाब विलयन में उपस्थित विलायक के मोल प्रभाज के समानुपाती होता है।
अवाष्पशील विलेय युक्त विलयन का वाष्प दाब केवल वाष्पशील विलायक A के आंशिक दाब के बराबर होता है। क्योंकि अवाष्पशील विलेय ठोस B का आंशिक दाब नगण्य होता है।
विलयन का वाष्प दाब P = PA
या P = P°A XA
XA + XB = 1 या XA = 1 – XB
तो P = P°A(1 – XB)
P = P°A – P°AXB
P°AXB = P°A – P

यदि घटक B अवाष्पशील विलेय हो तो
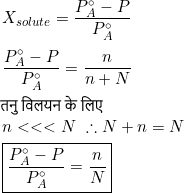
P°A – P वाष्प दाब में अवनमन तथा P°A – P/P°A वाष्प दाब में आपेक्षिक अवनमन कहलाता है।
Note :- यहां राउल्ट का नियम वाष्पशील और अवाष्पशील विलेय युक्त विलयनों के लिए दिया गया है। परीक्षाओं में जो पूछे आपको उसी को करना है। ज्यादा जानकारी के लिए अपनी किताब से एक बार जरूर मिला लें।
राउल्ट के नियम की सीमाएं
- राउल्ट का नियम तनु विलयन पर लागू होता है सान्द्र विलयन पर नहीं।
- राउल्ट का नियम केवल अवाष्पशील विलेय युक्त विलयनों पर लागू होता है।
- विद्युत अपघट्यों के विलयनों पर राउल्ट का नियम लागू नहीं होता है।
- जो पदार्थ विलयन में संगुणित या वियोजित होते हैं उन पर राउल्ट का नियम लागू नहीं होता है।
