विषय-सूची
मोलरता
1 लीटर विलयन में घुले हुए विलेय पदार्थ के मोलों की संख्या को उसे विलयन की मोलरता (Molarity in Hindi) कहते हैं। इसे M से व्यक्त करते हैं। मोलरता को मोलर सांद्रता भी कहा जाता है।
मोलरता ताप पर निर्भर करती है। ताप के बढ़ने पर विलयन का आयतन बढ़ जाता है जिसके परिणाम स्वरुप मोलरता कम हो जाती है।
मोलरता का सूत्र

विलेय के भार तथा अणुभार के रूप में मोलरता
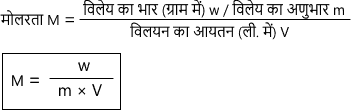
Note :- जब विलयन का आयतन लीटर में में लिया जाएगा तब गुना में 1000 नहीं लगेगा। लेकिन जब विलयन का आयतन मिलीलीटर में लिया जाएगा तब 1000 से गुना होगी।

मोलरता की इकाई (unit) मोल/लीटर (mol/L) होती है।
मोलरता का उपयोग रासायनिक अभिक्रिया में अभिकारकों की मात्राओं की गणना करने के लिए किया जाता है।
मोलरता के उदाहरण
- NaOH के 0.25 मोल/लीटर विलयन का अर्थ है कि NaOH के 0.25 मोल को 1 लीटर (1 क्यूबिक डेसीमीटर) विलयन में घोला गया है।
- 4 ग्राम कॉस्टिक सोडा (NaOH) को 100 मिली जल में घोला गया है तब प्राप्त विलयन की मोलरता ज्ञात कीजिए?
हल :- विलेय (NaOH) का भार = 4 g
NaOH का अणुभार = 23 + 16 +1 = 40
तब विलेय के मोल = भार/अणुभार
विलेय के मोल = 4/40 = 0.1 मोल
विलयन की मोलरता = विलेय के मोल/विलयन का आयतन (mL) × 1000
विलयन की मोलरता = 0.1/100 × 1000
विलयन की मोलरता = 1 M उत्तर
- 100 ग्राम सोडियम क्लोराइड (NaCl) को 1 लीटर जल में विलीन करने पर विलयन की मोलरता ज्ञात कीजिए?
हल :- विलेय (NaCl) का भार = 100 g
NaCl का अणुभार = 23 + 35.5 = 58.5
विलेय के मोल = भार/अणुभार
विलेय के मोल = 100/58.5 = 1.71 मोल
विलयन की मोलरता = विलेय के मोल/विलयन का आयतन (L)
विलयन की मोलरता = 1.71/1
विलयन की मोलरता = 1.71 M उत्तर
Note :- मोलरता से संबंधित सभी Numerical इसी प्रकार से होते हैं। सबसे पहले विलेय के मोल ज्ञात करो, फिर विलयन का आयतन तत्पश्चात विलयन की मोलरता का सूत्र लगाकर उत्तर ज्ञात हो जाता है।
आशा की जाती है की मोलरता का यह आर्टिकल आपके लिए मददगार रहा होगा। यदि आपका कोई प्रश्न हो तो कमेंट में लिखने में संकोच न करें।
