मोललता
1 किलोग्राम विलायक में घुले विलेय पदार्थ के मोलों की संख्या को उसे विलयन की मोललता (Molality in Hindi) कहते हैं। इसे m से व्यक्त करते हैं।
मोललता तापमान पर निर्भर नहीं करती है क्योंकि यह विलायक के द्रव्यमान पर आधारित होती है जो ताप के साथ परिवर्तित नहीं होता है।
मोललता का सूत्र
मोललता = विलेय के मोल/विलायक का द्रव्यमान (kg)
m = n/W
जब विलेय का भार तथा अणुभार ज्ञात हो तो

जब विलायक का द्रव्यमान ग्राम में हो तो मोललता
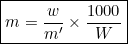
मोललता का मात्रक मोल/किलोग्राम (mol/kg) होता है।
मोललता का उपयोग विलयन के अणुसंख्यक गुणधर्मों जैसे – वाष्प दाब, हिमांग तथा क्वथनांक में परिवर्तन की गणना करने के लिए किया जाता है।
मोललता के उदाहरण
- 5.85 ग्राम NaCl 1 किलोग्राम जल में खुली हुई है। तो विलयन की मोललता ज्ञात कीजिए?
हल :- विलेय (NaCl) का भार = 5.85 g
NaCl का अणुभार = 23 + 35.5 = 58.5
विलेय NaCl के मोलों की संख्या= भार/अणुभार
विलेय के मोल = 5.85/58.5 = 0.1 मोल
तब विलयन की मोललता = विलेय के मोल/विलयन का द्रव्यमान
विलयन की मोललता = 0.1/1 = 0.1
अतः विलयन की मोललता = 0.1 m उत्तर
- 10 ग्राम कास्टिक सोडा (NaOH) को 500 ग्राम जल में घोला जाता है। प्राप्त विलयन की मोललता की गणना कीजिए?
हल :- विलेय (NaOH) का भार = 10 g
NaOH का अणुभार = 23 + 16 + 1 = 40
NaOH के मोलों की संख्या= भार/अणुभार
विलेय के मोल = 10/40 = 0.25 मोल
तब विलयन की मोललता = विलेय के मोल × 1000/विलयन का द्रव्यमान(g)
विलयन की मोललता = 0.25 × 1000/500 = 0.5
अतः विलयन की मोललता = 0.5 m उत्तर
- 20% K2CO3 विलयन की मोललता की गणना कीजिए?
हल :- 20% (भारानुसार) K2CO3 विलयन का अर्थ है
कि 100 ग्राम विलयन में K2CO3 का भार 20 ग्राम है।
इसलिए 100 ग्राम विलयन में विलायक का भार = 100-20 = 80g या 0.08 kg
K2CO3 का अणुभार = 2×39 + 12 + 3×16 = 138
तब विलयन की मोललता = विलेय के मोल/विलयन का द्रव्यमान (kg)
विलयन की मोललता = (विलेय का भार/विलेय का अणुभार)/विलयन का द्रव्यमान (kg)
विलयन की मोललता = (20/138)/0.08 = 1.8
अतः विलयन की मोललता = 1.8 m उत्तर
मोलरता और मोललता में अंतर
- मोलरता 1 लीटर विलयन में उपस्थित विलेय के मोलों की संख्या है। जबकि मोललता 1 किलोग्राम विलायक में उपस्थित विलेय के मोलों की संख्या है।
- मोलरता ताप पर निर्भर करती है क्योंकि ताप बदलने पर आयतन बदल जाता है। जबकि मोललता ताप पर निर्भर नहीं करती है क्योंकि ताप बदलने पर द्रव्यमान अपरिवर्तित रहता है।
Note :- 1 मोलल विलयन, 1 मोलर विलयन की अपेक्षा कम सांद्रता का होता है।
