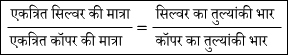वह प्रक्रिया जिसमें विद्युत अपघट्य अपनी गलित अवस्था या जलीय विलयन में विद्युत धारा प्रवाहित करने पर अपघटित हो जाता है। विद्युत अपघटन कहलाती है। आइये फैराडे के विद्युत अपघटन के दोनों नियम के बारे में अध्ययन करते हैं।
फैराडे के विद्युत अपघटन के नियम
माइकल फैराडे प्रथम वैज्ञानिक थे जिन्होंने विद्युत अपघटन के मात्रात्मक पक्षों का वर्णन किया और इलेक्ट्रोड पर मुक्त उत्पादों की मात्राओं एवं विद्युत धारा की मात्रा जो विलयन में प्रवाहित की जाती है के मध्य एक संबंध स्थापित किया। और दो निष्कर्ष प्राप्त किया जिसे फैराडे के विद्युत अपघटन के नियम (Faraday law of electrolysis in Hindi) कहते हैं।
यह नियम निम्न प्रकार से हैं।
फैराडे का विद्युत अपघटन का प्रथम नियम
इस नियम के अनुसार, विद्युत अपघटन की प्रक्रिया में किसी इलेक्ट्रोड विशेष पर किसी पदार्थ की एकत्रित अथवा मुक्त मात्रा पर उसे विलयन में प्रवाहित की गई विद्युत धारा की मात्रा के समानुपाती होती है।
यदि विलयन में मुक्त पदार्थ की मात्रा W ग्राम और विद्युत धारा की मात्रा Q कूलाम हो तो
फैराडे के प्रथम नियम के अनुसार
W ∝ Q
∵ Q = it तो
W ∝ it
W = Z × i × t
जहां Z एक नियतांक है जिसे विद्युत रासायनिक तुल्यांक (electrochemical equivalent) कहते हैं। इसका मात्रक ग्राम/कूलाम होता है।
तथा Q = आवेश (कूलाम में) i = धारा (एंपियर में) तथा t = समय (सेकंड में) है
तो यदि i = 1 तथा t = 1 हो तो
W = Z
अतः विद्युत रासायनिक तुल्यांक पदार्थ की वह मात्रा है जो विलयन में 1 एंपियर की धारा को 1 सेकंड तक प्रवाहित करने पर मुक्त होता है।
फैराडे का विद्युत अपघटन का द्वितीय नियम
इस नियम के अनुसार, जब विद्युत धारा की समान मात्रा को विभिन्न विद्युत अपघट्यों के विलयनों में प्रवाहित की जाती है तो इलेक्ट्रोड पर मुक्त (या एकत्रित) भिन्न-भिन्न पदार्थों की मात्राएं उनके तुल्यांकी भारों के समानुपाती होती है।
यदि इलेक्ट्रोड पर मुक्त आवेश की मात्रा W ग्राम तथा विद्युत अपघट्य का तुल्यांकी भार E हो तो
फैराडे के द्वितीय नियम के अनुसार
W ∝ E
दो विलयनों के लिए
W1 ∝ E1 और W2 ∝ E2
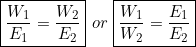
यदि Z1 तथा Z2 उपरोक्त पदार्थों के क्रमशः विद्युत रासायनिक तुल्यांक हों तथा विलयन में i एंपियर की धारा को t सेकंड तक प्रभावित किया गया हो तो
W1 = Z1it तथा W2 = Z2it
तो W1/W2 = E1/E2
Z1it/Z2it = E1/E2
Z1/Z2 = E1/E2
या E ∝ Z
या E = F × Z
जहां F एक नियतांक है जिसे फैराडे नियतांक कहते हैं। इसका मान 96487 या 96500 कूलाम होता है। तथा इस समीकरण द्वारा विद्युत रासायनिक तुल्यांक की भी गणना की जा सकती है।
उदाहरणार्थ :-
श्रेणीक्रम में जुड़े तीन विद्युत अपघट्यों विलयनों क्रमशः CuSO4 तथा AgNO3 से प्रवाहित किया जाए तो कॉपर एवं सिल्वर की एकत्रित मात्रा उनके तुल्यांकी भार के अनुपात में होती है।