क्वथनांक का उन्नयन
किसी द्रव का क्वथनांक वह ताप है जिस पर द्रव का वाष्प दाब वायुमण्डलीय दाब के बराबर हो जाता है।
किसी अवाष्पशील पदार्थ को किसी विलायक में घोलने पर विलायक के क्वथनांक में वृद्धि होती है क्वथनांक में उत्पन्न इस वृद्धि को क्वथनांक का उन्नयन (elevation of boiling point in Hindi) कहते हैं। इसे ∆Tb द्वारा व्यक्त किया जाता है।
यदि विलायक का क्वथनांक T°b तथा विलयन का क्वथनांक Tb हो तो
क्वथनांक का उन्नयन ∆Tb = Tb – T°b
एक विलयन का क्वथनांक शुद्ध विलायक के क्वथनांक तुलना में अधिक होता है।
क्वथनांक का उन्नयन का सूत्र
तनु विलयन में क्वथनांक का उन्नयन (∆Tb), विलयन में उपस्थित विलेय की मोलल सांद्रता (मोललता) के अनुक्रमानुपाती होता है।
∆Tb ∝ m
∆Tb = Kbm
जहां Kb एक स्थिरांक है। जिसे मोलल उन्नयन स्थिरांक कहते हैं। इसका मात्रक केल्विन-किग्रा/मोल (K-kg/mol) होता है। यह सूत्र क्वथनांक उन्नयन एवं मोललता में संबंध का सूत्र है।

जहां m’ = विलेय का अणुभार
w = विलेय पदार्थ की मात्रा
W = विलायक की मात्रा
Kb = मोलल उन्नयन स्थिरांक
∆Tb = क्वथनांक का उन्नयन है।
मोलल उन्नयन स्थिरांक
किसी विलायक के 1000 ग्राम में विलेय पदार्थ के 1 ग्राम को घोलने पर क्वथनांक में जो उन्नयन प्राप्त होता है उसे मोलल उन्नयन स्थिरांक (model elevation constant) कहते हैं। इसे Kb द्वारा व्यक्त किया जाता है।
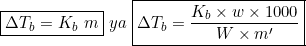
यदि m = 1 हो तो ∆Tb = Kb
अतः जब विलयन की मोललता का मान 1 होता है। तब विलयन के क्वथनांक का उन्नयन, मोलल उन्नयन स्थिरांक के बराबर होता है।
वांट हॉफ के अनुसार, Kb को विलायक के वाष्पन की गुप्त ऊष्मा से निम्न प्रकार द्वारा संबंधित किया जा सकता है।
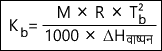
जहां M = विलायक का अणुभार
R = गैस स्थिरांक
Tb = विलायक का क्वथनांक
∆Hवाष्पन = वाष्पन की गुप्त ऊष्मा है।
क्वथनांक का उन्नयन के उदाहरण
- एक अवाष्पशील विलेय के 10 ग्राम को 100 ग्राम बेंजीन में घोलने पर बेंजीन के क्वथनांक में 1°C की वृद्धि पाई जाती है। तब विलेय पदार्थ के अणुभार की गणना कीजिए? (बेंजीन के लिए Kb = 2.53 K-kg/mol)
हल :- विलेय पदार्थ का भार (w) = 10 g
विलायक बेंजीन का भार (W) = 100 g
मोलल उन्नयन स्थिरांक (Kb) = 2.53 K-kg/mol
क्वथनांक का उन्नयन ∆Tb = 1°C या 1K
क्वथनांक का उन्नयन के सूत्र से

अतः विलेय पदार्थ का अणुभार 253 g/mol है।
Note :- ∆Tb का मान केल्विन तथा सेल्सियस स्केलों पर समान होता है।
- 9 ग्राम ग्लूकोस को 150 ग्राम जल में घोलने पर विलयन का क्वथनांक 100.17 °C है। जल के लिए Kb की गणना कीजिए?
हल :- विलेय ग्लूकोस का भार (w) = 9 g
विलायक जल का भार (W) = 150 g
ग्लूकोस का अणुभार (m’) = 180
जल के लिए Kb = ?
∆Tb = विलयन का क्वथनांक – विलायक का क्वथनांक 100.17 – 100 = 0.17°C
क्वथनांक का उन्नयन के सूत्र से

अतः जल के लिए Kb का मान 0.51 K-kg/mol है।
