इकाई समय में किसी अभिकारक अथवा उत्पाद की सांद्रता परिवर्तन को रासायनिक अभिक्रिया का वेग या दर कहते हैं। आइये अभिक्रिया के औसत और तात्क्षणिक वेग पर अध्ययन करते हैं।
अभिक्रिया का औसत वेग
किसी रासायनिक अभिक्रिया में उपस्थित अभिकारक या उत्पाद की सांद्रता में होने वाले प्रति इकाई समय परिवर्तन को अभिक्रिया का औसत वेग (average velocity in hindi) कहते हैं। औसत अभिक्रिया वेग को rav द्वारा व्यक्त किया जाता है।

अभिक्रिया के औसत वेग को सामान्य अभिक्रिया द्वारा समझते हैं।
A → B
इस अभिक्रिया के वेग को दो प्रकार व्यक्त किया जा सकता है।
(i) अभिकारक A के सांद्रण में कमी :-
अभिक्रिया का औसत वेग = अभिकारक A के सांद्रण में कमी/समयान्तराल
माना t1 समय पर A का सांद्रण [A]1 तथा t2 समय पर A का सांद्रण [A]2 है तो
A की मोलर सांद्रण में कमी = [A]2 – [A]1 = ∆[A]
समयान्तराल = t2 – t2 = ∆t

ऋणात्मक चिन्ह दर्शाता है कि अभिकारक A की सांद्रता में समय के साथ-साथ कमी हो रही है।
(ii) उत्पाद B के सांद्रण में वृद्धि :-
अभिक्रिया का औसत वेग = उत्पाद B के सांद्रण में वृद्धि/समयान्तराल
माना ∆t समयान्तराल में उत्पाद B के सांद्रण में होने वाली वृद्धि ∆[B] है तो

धनात्मक चिन्ह दर्शाता है कि उत्पाद B की सांद्रता में समय के साथ-साथ वृद्धि हो रही है।

अभिक्रिया का तात्क्षणिक वेग
किसी निश्चित क्षण पर अभिकारक या उत्पाद की सांद्रता में होने वाले परिवर्तन को उस अभिक्रिया का तात्क्षणिक वेग (instantaneous velocity in hindi) कहते हैं। इसे rinst द्वारा व्यक्त किया जाता है।
तात्क्षणिक वेग के निर्धारण में समयान्तराल ∆t का मान अतिलघु लिया जाता है। गणितीय रूप में ∆ के स्थान पर d व्यक्त करते हैं। तो अनंत सूक्ष्म dt के लिए तात्क्षणिक वेग को निम्न प्रकार व्यक्त किया जा सकता है।
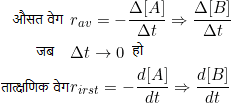
एक सामान्य अभिक्रिया के लिए
aA + bB → cC + dD

तात्क्षणिक वेग का उदाहरण
- H2 (g) + I2 (g) → 2HI (g)
तात्क्षणिक वेग = -d[H2]/dt = -d[I2]/dt = ½ d[HI]/dt
- 2NO + Br2 → 2NOBr
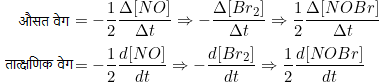
महत्वपूर्ण बिंदु :- औसत वेग में ∆ चिन्ह तथा तात्क्षणिक वेग में d का प्रयोग किया जाता है।
