रासायनिक बलगतिकी नोट्स
रसायन विज्ञान की वह शाखा जिसके अंतर्गत रासायनिक अभिक्रियाओं के वेग, अभिक्रिया के वेग को प्रभावित करने वाले कारक तथा अभिक्रिया की क्रियाविधि का अध्ययन किया जाता है। रासायनिक बलगतिकी (chemical kinetics in Hindi) कहलाती है। kinetics शब्द की व्युत्पत्ति ग्रीक भाषा के शब्द kinesis से हुई है जिसका अर्थ होता है गति।
उष्मागतिकी द्वारा अभिक्रिया को केवल संभाव्यता का पता चलता है जबकि रासायनिक बलगतिकी द्वारा अभिक्रिया की गति का पता चलता है।

अभिक्रियाओं के प्रकार
तीव्र अभिक्रियाएं :- वे रासायनिक अभिक्रियाएं जो अत्यंत तीव्र गति से संपन्न हो जाती हैं तीव्र अभिक्रिया कहलाती हैं। इन अभिक्रियाओं का वेग अत्यधिक होता है। आयनिक, अवक्षेपण तथा उदासीनीकरण अभिक्रियाएं तीव्र अभिक्रियाओं के उदाहरण हैं।
NaOH + HCl → NaCl + H2O
मंद अभिक्रियाएं :- वे रासायनिक अभिक्रियाएं जो कुछ सेकंडों, मिनटों या दोनों में संपन्न हो जाती हैं मंद अभिक्रियाएं कहलाती हैं। इन अभिक्रियाओं का वेग प्रायः कम होता है। सभी आण्विक अभिक्रियाएं इसके उदाहरण हैं।

पढ़ें… d- एवं f-ब्लॉक के तत्व नोट्स – Class 12th Chemistry chapter 4 Notes in Hindi
पढ़ें… विद्युत रसायन नोट्स – Class 12th Chemistry chapter 2 Notes in Hindi PDF
अभिक्रिया की दर
एकांक समय में किसी अभिकारक या उत्पाद की सांद्रता में होने वाले परिवर्तन को रासायनिक अभिक्रिया की दर कहा जाता है।

अभिक्रिया की दर का मात्रक मोल/लीटर-सेकंड होता है। यदि अभिकारक या उत्पाद गैसीय अवस्था में हैं तो अभिक्रिया की दर का मात्रक वायुमंडल/सेकंड होता है।
अभिक्रिया की अर्ध-आयु
वह समय जिसमें अभिकारक की सांद्रता उसकी प्रारंभिक सांद्रता की आधी रह जाती है। अभिक्रिया की अर्ध-आयु कहलाती है इसे t½ द्वारा व्यक्त किया जाता है।
शून्य कोटि की अभिक्रिया के लिए :-
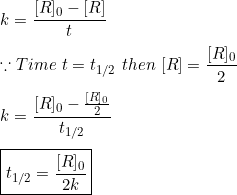
अतः स्पष्ट होता है कि शून्य कोटि की अभिक्रिया में अर्ध-आयु t½ अभिकारक की प्रारंभिक सांद्रता के समानुपाती तथा वेग स्थिरांक के व्युक्रमानुपाती होती है।
प्रथम कोटि की अभिक्रिया के लिए :-

अतः स्पष्ट है की प्रथम कोटि की अभिक्रिया अभिकारकों की प्रारंभिक सांद्रता पर निर्भर नहीं करती है। यह केवल वेग स्थिरांक पर निर्भर करती है।
Class 12th Chemistry chapter 3 Notes in Hindi
- प्रथम कोटि की अभिक्रिया में अभिकारक की सांद्रता n गुना बढ़ाने पर वेग में भी n गुना वृद्धि होती है।
- अभिकारकों की औसत ऊर्जा के अतिरिक्त वह ऊर्जा जो उत्पाद बनाने के लिए आवश्यक होती है। सक्रियण ऊर्जा कहलाती है।
- शून्य कोटि की अभिक्रिया के लिए वेग स्थिरांक का मात्रक मोल/लीटर-सेकंड तथा प्रथम कोटि की अभिक्रिया के लिए वेग स्थिरांक का मात्रक प्रति सेकंड (sec-1) होता है।
- वे प्रथम कोटि की अभिक्रियाएं जिनकी आण्विकता एक से अधिक होती है आभासी एकाणुक अभिक्रियाएं कहलाती हैं इस प्रकार की अभिक्रियाओं में एक अभिकारक आधिक्य में होता है।
- अभिक्रिया की आण्विकता सदैव पूर्ण संख्या तथा धनात्मक होती है जबकि अभिक्रिया की कोटि का मान भिन्नात्मक तथा ऋणात्मक भी हो सकता है।
रासायनिक बलगतिकी चैप्टर के अन्य टॉपिक
Class 12 chemistry chapter 3 notes में कई महत्वपूर्ण टॉपिक सम्मिलित हैं। जिन पर परीक्षाओं में प्रश्न आने की संभावना अधिकतम होती है। आइये इन सभी टॉपिक्स को पर अध्ययन करते हैं।
निष्कर्ष
रासायनिक बलगतिकी एक महत्वपूर्ण चैप्टर है इस चैप्टर में अनेक महत्वपूर्ण टॉपिक्स शामिल हैं। Gyan Rani द्वारा लगभग इन सभी पर अध्ययन आसान भाषा में किया गया है। जिससे छात्रों को समझने में आसानी हो। एवं अपनी प्रश्न एवं परेशानियों को हमसे अवश्य साझा करें।
