विद्युत रसायन नोट्स
रसायन विज्ञान की वह शाखा जिसमें रासायनिक ऊर्जा तथा विद्युत ऊर्जा के परस्पर रूपांतरण तथा उनके मध्य संबंध का अध्ययन किया जाता है। विद्युत रसायन (electrochemistry in Hindi) कहलाती है।
यह विषय सैद्धांतिक अध्ययन एवं प्रायोगिक उपयोगिता दोनों ही विचारों से महत्वपूर्ण है। इस प्रकार के प्रक्रमों का आधार रेडॉक्स अभिक्रिया है इस प्रकार की अभिक्रियाएं न केवल रासायनिक प्रक्रमों के लिए महत्वपूर्ण है अपितु यह हमारे सामान्य जीवन के लिए भी आवश्यक हैं।

विद्युत अपघटनी विलयनों में चालकत्व
धात्विक चालक तथा विद्युत अपघट्य विलयन दोनों ही विद्युत धारा के संचालन में सक्षम होते हैं। धात्विक तथा विद्युत अपघटनी चालक ओम के नियम का पालन करते हैं।
चालक के प्रतिरोध के व्युत्क्रम को विद्युत चालकता कहते हैं।
C = 1/R
यहां R प्रतिरोध है जिसका मात्रक ओम (Ω) तथा विद्युत चालकता का मात्रक प्रति ओम (Ω-1) या mho होता है।
पढ़ें… रासायनिक बलगतिकी नोट्स – Class 12th Chemistry chapter 3 Notes in Hindi PDF
पढ़ें… विलयन नोट्स – Class 12th Chemistry chapter 1 Notes in Hindi PDF
विशिष्ट चालकता
किसी चालक की विशिष्ट प्रतिरोध के व्युत्क्रम को चालक की विशिष्ट चालकता कहा जाता है। इसे κ (कप्पा) द्वारा व्यक्त करते हैं।

विशिष्ट चालकता का मात्रक Ω-1-cm-1 या सीमेन्ज/सेमी होता है।
तुल्यांकी चालकता
किसी विलयन के एक निश्चित आयतन में उपस्थित विद्युत अपघट्य के एक ग्राम तुल्यांक को घोलने पर प्राप्त विलयन की चालकता को तुल्यांकी चालकता (equivalent conductivity) कहते हैं। इसे Λeq द्वारा व्यक्त किया जाता है।
Λeq = κ × V
तुल्यांकी चालकता का मात्रक सेमी2/ओम-तुल्यांक होता है। इसे cm2/Ω-eq द्वारा व्यक्त करते हैं।
मोलर चालकता
किसी विलयन के एक निश्चित आयतन में उपस्थित विद्युत अपघट्य के 1 ग्राम-अणु को घोलने पर प्राप्त विलयन की चालकता को मोलर चालकता (molar conductivity) कहते हैं। इसे Λm द्वारा व्यक्त करते हैं।
Λm = κ × V
मोलर चालकता का मात्रक सेमी2/ओम-मोल (cm2/Ω-mol) होता है।

सेल नियतांक
किसी विलयन में चालक की लंबाई तथा उसके अनुप्रस्थ काट के क्षेत्रफल के अनुपात को सेल नियतांक कहते हैं इसे x द्वारा व्यक्त करते हैं।
सेल नियतांक x = ℓ/A
विशिष्ट चालकता = चालकता × सेल नियतांक
κ = C × x
Class 12th Chemistry chapter 2 Notes in Hindi
- विद्युत अपघटनी सेल का कैथोड ऋणात्मक ध्रुव होता है क्योंकि वह बैटरी के ऋणात्मक टर्मिनल से जुड़ा रहता है।
- गैल्वेनिक सेल में एक इलेक्ट्रोड पर ऑक्सीकरण क्रिया तथा दूसरे इलेक्ट्रोड पर अपचयन क्रिया होती है।
- विद्युत रासायनिक श्रेणी में ऊपर से नीचे की ओर जाने पर धातुओं की अपचायक क्षमता घटती है।
- कोलराउश के नियम का अनुप्रयोग दुर्बल विद्युत अपघट्य की मोलर चालकता ज्ञात करने में होता है।
- लोहे पर जंग लगना एक विद्युत रासायनिक अभिक्रिया है रासायनिक रूप से जंग जलयोजित फेरिक ऑक्साइड (Fe2O3·xH2O) है।
विद्युत रासायनिक सेल
जब समान अथवा विभिन्न प्रकार के विद्युत अपघट्यों के विलयनों में डूबे इलेक्ट्रोड रासायनिक ऊर्जा को विद्युत ऊर्जा में अथवा विद्युत ऊर्जा को रासायनिक ऊर्जा में परिवर्तित करने का कार्य करते हैं। तो इस संयंत्र को विद्युत रासायनिक सेल (electrochemical cell) कहते हैं।
विद्युत रासायनिक सेल दो प्रकार के होते हैं।
1. विद्युत अपघटनी सेल
2. गैल्वेनिक सेल
लवण सेतु
यह एक U आकार की कांच की नली होती है जो विद्युत रासायनिक अर्ध सेल को जोड़ती है। इसमें किसी विद्युत अपघट्यों जैसे – KCl, KNO3, K2SO4 आदि का सान्द्र विलयन भरा होता है।
लवण सेतु के कार्य
लवण सेतु मुख्य रूप से दो कार्य को संपन्न करता है।
1. लवण सेतु एक अर्धसेल से दूसरे अर्धसेल में आयनों के परिगमन को स्वतंत्र रूप से प्रवाहित होने देता है जिससे विद्युत प्रवाह उत्पन्न होता है।
2. लवण सेतु दोनों अर्ध-सेलों की विद्युत उदासीनता बनाए रखने में मदद करता है। यदि लवण सेतु न हो तो एक अर्धसेल में धनायन की अधिकता अथवा दूसरे में ऋणायन की अधिकता हो जाती है। जिसके कारण विद्युत धारा का प्रवाह रुक जाता है।
रेडॉक्स विभव
जब किसी सेल में ऑक्सीकरण तथा अपचयन अभिक्रिया होती है तो धातु तथा विलयन में उपस्थित आयनों के मध्य स्थापित होने वाले विभवांतर को रेडॉक्स विभव कहते हैं।
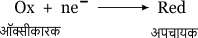
यदि 25°C ताप पर सेल विभव E हो तो ऑक्सीकारक की सांद्रता [Ox] तथा अपचायक की सांद्रता [Red] में निम्न संबंध होता है।

विद्युत रसायन चैप्टर के अन्य टॉपिक
Class 12 Chemistry chapter 2 Notes में कई महत्वपूर्ण टॉपिक शामिल है जिन पर प्रशन अधिकतर पूछे जाते हैं आइये इन सभी टॉपिक पर अध्ययन करते हैं।
निष्कर्ष
प्रस्तुत लेख को Gyan Rani टीम द्वारा रसायन विज्ञान कक्षा 12 अध्याय 2 नोट्स को बहुत ही अच्छे से आसान शब्दों का प्रयोग करके तैयार किया है। इस chapter के लगभग सभी टॉपिक को यहां रखने का प्रयास किया गया है। अगर आपका इस अध्याय से related कोई प्रश्न है तो एक बार हमारे साथहमसे करने में संकोच न करें। धन्यवाद
